
입력2024.02.08 08:13
수정2024.02.08 08:13
글 한상춘 한국경제신문 논설위원·한국경제TV 해설위원
ⓒ 한경닷컴, 무단전재 및 재배포 금지
관련 뉴스
-
1
에스티큐브, 법차손 등 관리종목 사유 발생해 거래 정지
한국거래소 코스닥시장본부는 관리종목 지정 우려로 면역항암제 개발기업 에스티큐브에 대해 주권매매거래 정지를 결정했다고 2일 공시했다.정지 사유는 관리종목 지정 우려다. 최근 3년간 2회이상 법인세비용차감전 계속사업손실(법차손)이 자기자본의 50%를 초과한 것 때문이다.에스티큐브는 2023년 법차손이 244억원으로 자기자본(353억원)의 69.2%를 기록했다. 이 비율은 2022년엔 36.9%, 2021년 133.2%를 기록했다. 에스티큐브의 2023년 매출은 58억원으로 작년(63억원) 대비 7.9%하락했고 영업손실은 189억원에서 259억원을 불어났다. 회사측은 공시를 통해 “BT사업부문(신약 후보물질 개발) 임상1상 및 1b·2상 진행에 따른 임상비용 증가로 인한 영업손실, 당기순손실이 증가했다”고 해명했다. 한편 에스티큐브측은 면역항암제 ‘넬마스토바트’ 임상에 전념하며 관리종목 지정 사유를 해소하겠다고 이날 밝혔다. 회사 측은 지난해 임상 1상 종료 및 임상 1b·2상 시작 시기가 맞물리면서 4분기에 임상 개발 비용이 한꺼번에 집행됨에 따라 손실이 증가했다고 해명했다.정현진 에스티큐브 대표는 “결과적으로 미리 대비하지 못한 불찰에 대해 주주 여러분들에게 진심으로 사과드린다”며 “지난해 임상이 예상보다 빠르게 진행되며 일정 기간의 재무 요건을 충족하지 못해 관리종목 이슈가 발생했지만, 현재 유동성에 문제가 없고 넬마스토바트의 본질 가치와도 관련이 없는 사항이기 때문에 회사는 진행 중인 임상에 더욱 전념하고 있다”고 말했다.정 대표는 이어 “지속적으로 기술수출 등 안정적인 매출 확보 방안을 마련하기 위해 노력하고 있었던 만큼, 연내 가시화된 성과를 통해 관리종목 지정 사유를 충분히 탈피할 수 있을 것”이라며 “임시방편식 대처가 아니라 본질적 기업가치 상승과 목표 달성을 위해 앞으로 나아갈테니 지켜봐달라”고 강조했다.한편 에스티큐브는 넬마스토바트 임상 1b·2상 단계 환자 투약을 준비하고 있다. 소세포폐암 임상과 대장암 연구자 임상을 진행해 근시일 내 첫 환자 투약을 시작할 계획이다.안대규 기자 powerzanic@hankyung.com
-
2
헬릭스미스의 유전자치료제 ‘엔젠시스’가 중증하지허혈(CLI) 환자들을 대상으로 한 중국 임상 3상에서 주요 평가지표를 달성했다. 유효성을 입증된 만큼 신약허가에 나설 것으로 풀이된다. 헬릭스미스는 중국 파트너사인 노스랜드 바이오텍이 중증하지허혈(CLI)을 대상으로 한 엔젠시스(VM202, 중국명 NL003) 임상 3상에서 주평가지표를 달성했다고 2일 밝혔다.노스랜드 측이 발표한 결과에 따르면 1차 평가지표인 궤양 완치율이 위약 대조군에 비해 유의하게 우수했고(p<0.0001), 안전성도 양호했으며 심각한 이상반응은 발견되지 않았다.노스랜드사는 휴지기 통증 감소를 주평가지표로 하는 임상 3상 (300명 규모)과 궤양 완치를 주평가지표로 하는 임상 3상 (240명 규모), 두 개의 독립적인 임상 3상을 2019년 7월부터 중국 전역의 24개 임상시험센터에서 진행해 왔다. 이번 결과 발표는 궤양 완치 목적의 임상 3상에 대한 결과다. 통증 감소를 목표로 하는 나머지 임상 3상에 대해서는 올해 3분기 중 결과를 발표할 예정이다.노스랜드 측은 현지 보도자료를 통해 “이번 임상시험 결과를 바탕으로 NDA 신청 준비 및 상업화 준비에 박차를 가할 것”이라고 밝혔다.중증하지허혈은 중증 당뇨환자들에게서 나타나는 질환이다. 다리에서 혈액순환이 제대로 이뤄지지 않아 조직이 괴사하는 것을 말한다. 헬릭스미스가 최근 실패 소식을 전한 미국 임상은 당뇨병성 신경병증을 대상으로 한 시험이었다. 주관적인 통증 개선 효과를 임상으로 증명해야 해 객관적 평가가 어렵다는 지적이 있었다.노스랜드 측은 2025년 엔젠시스의 중국 현지 상업화를 위해 베이징 외곽에 총 1만 2천 평 규모의 생산 설비를 구축하고 있으며, 이 중 엔젠시스 생산 전용 시설은 3900평 규모다. 이는 연간 10만 명의 CLI 환자들에게 엔젠시스를 투약할 수 있는 규모로, 약가를 1200만원으로 추정할 경우 연 매출 1조 2000억 원이 발생할 것으로 예상된다. 2004년 헬릭스미스와 노스랜드 바이오텍은 공동개발계약을 체결했으며, 노스랜드가 엔젠시스를 중국에 시판할 시 헬릭스미스는 일정 기간 동안 로열티를 수령할 수 있다.헬릭스미스는 “엔젠시스의 족부궤양에 대한 완치 효과가 대규모 임상 3상에서 입증되었다”며 “이는 엔젠시스를 인체에 주사하면 혈관생성 및 신경재생을 촉진하여 임상적 효과를 나타낼 수 있다는 가정을 증명한 결과”라고 설명했다. 이어 “향후 이와 같이 다양한 적응증에 엔젠시스를 활용하고자 하는 관련 신약개발 기업들을 상대로 기술수출 논의가 더욱 활발하게 진행될 것으로 예상된다”라고 밝혔다.이우상 기자 idol@hankyung.com
-
3
지아이셀, 지아이이노베이션과 차세대 항암제 병용요법 도전
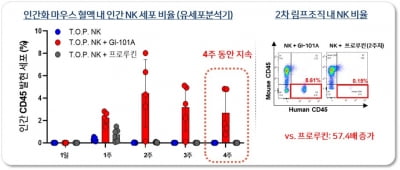
지아이이노베이션과 관계사 지아이셀이 차세대 항암제를 함께 쓰는 병용요법의 안전성·유효성 평가를 위한 임상1·2a상 임상시험 신청서를 식품의약품안전처에 제출했다고 1일 밝혔다. 지아이셀측은 단독 요법보다 항암효능이 월등히 뛰어나고 생산원가도 절감할 수 있을 것으로 기대하고 있다.해당 임상시험은 이전 항암제가 효과가 없거나(불응성) 재발성 고형암 환자를 대상으로 진행된다. 지아이셀의 동종유래 자연살해(NK) 면역세포치료제인 T.O.P. NK와 지아이이노베이션의 차세대 면역항암제인 GI-101A 병용요법의 안전성 및 잠재적 유효성을 평가하기 위한 국내 1·2a상 임상시험이다. 양사는 향후 추가적인 협업을 통해 T.O.P. NK와 GI-102의 병용요법 임상도 돌입할 예정이다.T.O.P. NK는 대량배양이 가능하고 종양 타깃능력과 암세포 살상효율을 극대화한 차세대 NK세포치료제다. 현재 재발성·불응성 고형암 및 혈액암 환자를 대상으로 진행중인 단독요법 임상 1상에서 우수한 효능을 보여주고 있다.임상 1상 중간 결과에 따르면 표준치료에 실패한 비호지킨 림프종 환자에 T.O.P. NK를 3회 투약 후 첫번째 종양평가를 수행한 결과 암세포가 완전히 사라지는 완전관해(CR)를 확인했다. 또한 최소 3번의 표준치료에 실패한 4명의 직장암 환자 중 3명에서 6개월 이상 투약이 진행됐으며 이중 2명에서는 종양이 감소하는 안정적병변(SD)을 확인했다. 지아이셀측은 “NK세포치료제의 단독요법 임상임에도 재발성 림프종에서 강력한 효능을 확인했다”며 “특히 직장암의 3차 표준치료제의 무진행 생존기간 (mPFS)이 약 2개월인 점을 고려하면 직장암에서도 굉장히 고무적인 결과를 보여줬다”고 설명했다.보통 암세포는 자신을 공격하기 위해 모여든 T세포의 기능을 무력화시켜 오히려 일부 T세포를 자기 편으로 활용한다. T세포와 NK세포의 공격능력을 낮추는 ‘조절T세포’를 암세포 주변에 가득 배치하는 것도 그 사례다. 지아이이노베이션이 개발한 GI-101A의 한 축은 조절T세포의 주요한 기능을 담당하는 CTLA-4를 타깃으로 한다. CTLA-4에 잘 붙을 수 있도록 CD80이라는 단백질을 GI-101 한쪽 끝에 단 것이다. CD80이 CTLA-4에 결합하면 조절T세포 기능을 막게 된다. GI-101A는 다른 한 축에는 면역세포 증식을 돕는 인터루킨2(IL-2)를 달았다. 인터루킨2는 일종의 신호물질로, 인터루킨2가 T세포와 NK세포에 결합하면 이들 항암 면역세포를 증식시키면서 공격력이 높아진다.지아이이노베이션의 GI-101A는 현재 면역항암제 키트루다와 병용요법으로 국내와 미국에서 임상 1·2상을 진행중이다. 해당 임상에서 GI-101A가 면역항암제에 내성이 있는 암환자의 면역세포를 무진행 생존기간을 현저히 증가시킴을 확인한 바 있다. 또한 GI-102는 GI-101A대비 알파 수용체 결합력을 더욱 떨어뜨린 신약후보물질(파이프라인)이다. 조절T세포에 붙을 수 있는 인터루킨2의 결합력을 약화시키고 T세포와 NK세포 증식 활성화에 더 집중하도록 설계됐다. 특히 단백질에 코팅을 입혀 몸속에서 오랜 기간 파괴되지 않아 제형 변경 없이도 피하주사(SC)가 가능하도록 했다. 최근 기존 치료법에 불응 또는 재발한 흑색종 환자를 대상으로 43%의 객관적반응률(ORR)과 면역세포의 수를 평균 7배 증가시키는 전례 없는 임상 1·2a상 결과를 발표한 바 있다.양사는 인간화 마우스를 이용한 비임상 시험에서 GI-101A 또는 GI-102와 T.O.P. NK의 병용투여 시, T.O.P. NK의 체내 지속성이 1개월간 유지되고 T.O.P. NK 단독투여 대비 항암효능이 월등히 증가함을 확인했다. 지아이셀은 이러한 결과를 바탕으로 GI-101A·GI-102와의 병용요법에서 T.O.P. NK의 투여 용량을 단독요법 대비 수배에서 수십배 낮춤으로써 생산원가를 줄여 상업성을 극대화 할 수 있을 것으로 기대하고 있다. 장명호 지아이셀 최고임상과학고문은 “최근 첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률 일부개정안(첨생법 개정안)의 국회 본회의 통과로 말기암 환자뿐만 아니라 초기암 및 수술 후 환자분들도 세포·유전자 치료를 받을 수 있는 길이 열렸다”며 “GI-101A·GI-102와 T.O.P. NK의 병용요법의 성공적인 개발을 통해 더 많은 환자분들이 혜택을 보실 수 있도록 최선을 다하겠다”고 말했다.한편 지아이셀은 임상용 NK 세포치료제의 원활한 생산을 위해 자체적인 1000평 규모의 GMP(우수 의약품 제조·관리 기준) 시설을 갖추고 첨생법에서 규정하는 허가 3종인 첨단바이오의약품 제조업 허가, 인체세포 등 관리업 허가, 세포처리시설 허가를 모두 취득한 바 있다. 안대규 기자 powerzanic@hankyung.com





![촌극이 따로 없네…어처구니 없는 실수에 혹평 쏟아진 개막식 [2024 파리올림픽]](https://wchsmo.org/wp-content/uploads/2024/07/ZA.37470413.1.jpg)
